Semana #3
QUÍMICA
La Ley de Graham, formulada en 1829 por el químico británico Thomas Graham, establece que las velocidades de difusión y efusión de los gases son inversamente proporcionales a las raíces cuadradas de sus respectivas masas molares.
Siendo v las velocidades y M las masas molares.
Efusión es el flujo de partículas de gas a través de orificios estrechos o poros. Se hace uso de este principio en el método de efusión de separación de isótopos.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia se distribuyen uniformemente en el espacio libre. Si hay una aglomeración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor aglomeración a una región de menor aglomeración.
Ley de gases ideales:
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
En 1648, el químico Jan Baptista van Helmont creó el vocablo gas, a partir del término griego kaos (desorden) para definir las génesis características del anhídrido carbónico. Esta denominación se extendió luego a todos los cuerpos gaseosos y se utiliza para designar uno de los estados de la materia.
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante, o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de un gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así:
P . V = K
donde es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
P1 . V2 = P1 . V2
Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, aparentemente de manera independiente por August Krönig en 1856 y Rudolf Clausius en 1857. La constante universal de los gases se descubrió y se introdujo por primera vez en la ley de los gases ideales en lugar de un gran número de constantes de gases específicas descritas por Dmitri Mendeleev en 1874.
En este siglo, los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes.
Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834 como una combinación de la ley de Boyle y la ley de Charles.
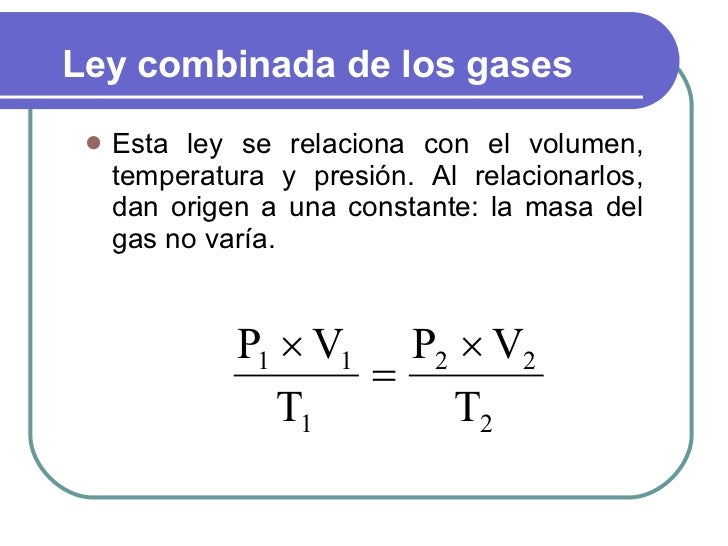
Ley combinada:
QUÍMICA ORGÁNICA
Compuestos Organicos:
Se consideran compuestos orgánicos a todas aquellas sustancias químicas que contienen algún átomo de carbono en su molécula. La diferencia fundamental entre un compuesto orgánico y uno inorgánico es que el primero cuenta con enlaces del tipo carbono-carbono, carbono-nitrógeno o carbono hidrógeno, mientras que los inorgánicos no tienen este tipo de enlaces.
Formas alotrópicas del carbono:
BIOLOGÍA
Qué es la Indagación?
La indagación es un proceso dinámico que consiste en estar abiertos a experimentar asombro y perplejidad, y llegar a conocer y entender el mundo. Como tal, es una postura que impregna todos los aspectos de la vida y resulta esencial para la manera en que el conocimiento se crea. La indagación se basa en la creencia de que el entendimiento del mundo se construye a través del proceso de trabajo y conversación entre varias personas, juntas, y en la medida que estas personas plantean y resuelven problemas, realizan descubrimientos y prueban de manera rigurosa los descubrimientos que surgen en el curso de su actividad compartida.
- Investigar
- Comprobar fenómeno
- Preguntar
- Informaron
- Formular hipótesis
Lectura con folleto:
Primera propuesta "El Origen"
Esta propuesta afirma que la vida salio del agua, formando organismo por las células de agua.
Esto se propone que sucedió hace 45 millones de años.

Comments
Post a Comment